Презентация Физико-химические свойства белков онлайн
На нашем сайте вы можете скачать и просмотреть онлайн доклад-презентацию на тему Физико-химические свойства белков абсолютно бесплатно. Урок-презентация на эту тему содержит всего 35 слайдов. Все материалы созданы в программе PowerPoint и имеют формат ppt или же pptx. Материалы и темы для презентаций взяты из открытых источников и загружены их авторами, за качество и достоверность информации в них администрация сайта не отвечает, все права принадлежат их создателям. Если вы нашли то, что искали, отблагодарите авторов - поделитесь ссылкой в социальных сетях, а наш сайт добавьте в закладки.
Презентации » Химия » Физико-химические свойства белков
Оцените!
Оцените презентацию от 1 до 5 баллов!
- Тип файла:ppt / pptx (powerpoint)
- Всего слайдов:35 слайдов
- Для класса:1,2,3,4,5,6,7,8,9,10,11
- Размер файла:14.52 MB
- Просмотров:73
- Скачиваний:1
- Автор:неизвестен
Слайды и текст к этой презентации:
№5 слайд


Содержание слайда: Методы разделения белков по заряду
1. Электрофорез – движение заряженных частиц в электрическом поле.
Скорость движения зависит от:
Разности потенциалов;
Молекулярной массы;
Формы белковой молекулы;
Взаимодействия со средой движения;
pH и состава буфера.
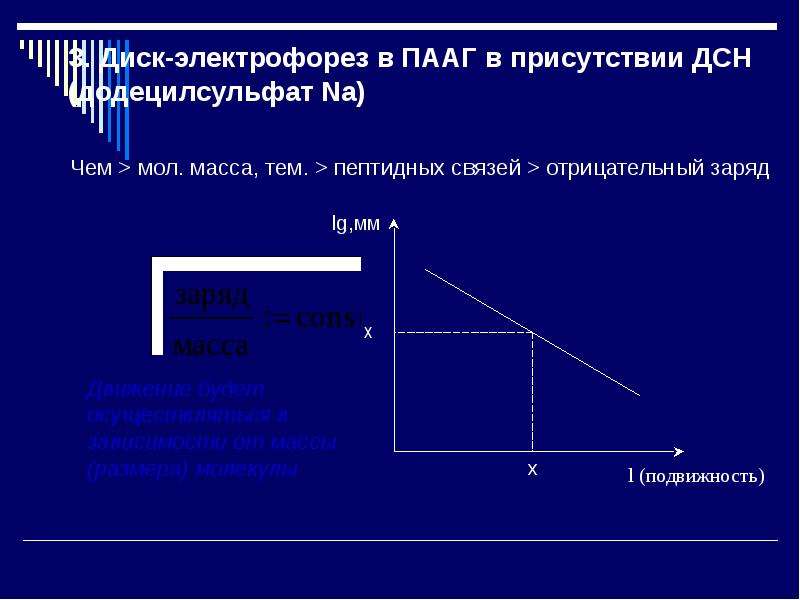
Зональный ЭФ на носителях:( бумаге, агар-агаре, крахмале, ПААГ)
№8 слайд


Содержание слайда: Молекулярная масса белков
Зависит от:
Особенностей первичной структуры;
Наличия четверичной структуры;
Массы небелковой части (простой белок или сложный)
Молекулярные массы некоторых белков:
Инсулин 5 733
Миоглобин кашалота 17 600
Пепсин 35 000
Альбумин яичный 46 000
Гемоглобин лошади 68 000
γ – глобулин человека 160 000
Каталаза 250 000
Фибриноген человека 450 000
Глутаматдетидрогеназа 1 000 000
Гемоцианин улитки 6 000 000
Вирус табачной мозайки 40 000 000
№21 слайд


Содержание слайда: Нативный белок – белок с неизменной структурой и свойствами.
Нативный белок – белок с неизменной структурой и свойствами.
Факторы денатурации:
Физические (t, давление, УЗ)
Химические (кислоты, щелочи, тяжелые металлы)
Биологические (протеолитические ферменты)
Признаки денатурации:
Потеря биологической активности;
Изменение конформации белковой молекулы;
Увеличение числа функциональных групп (появляются гидрофобные);
Уменьшение растворимости и осаждение;
Изменение вязкости, оптической активности, прозрачности растворов белка;
Изменение окрашиваемости (гистология);
Большая доступность действию протеолитических ферментов.
№23 слайд


Содержание слайда: Гомогенизация – разрушение ткани, клеток
Гомогенизация – разрушение ткани, клеток
Экстракция – извлечение белка различными растворителями (вода, слабые солевые растворы)
Разделение экстракта на индивидуальные белки (высаливание, pJ-осаждение, дифференциальное центрифугирование)
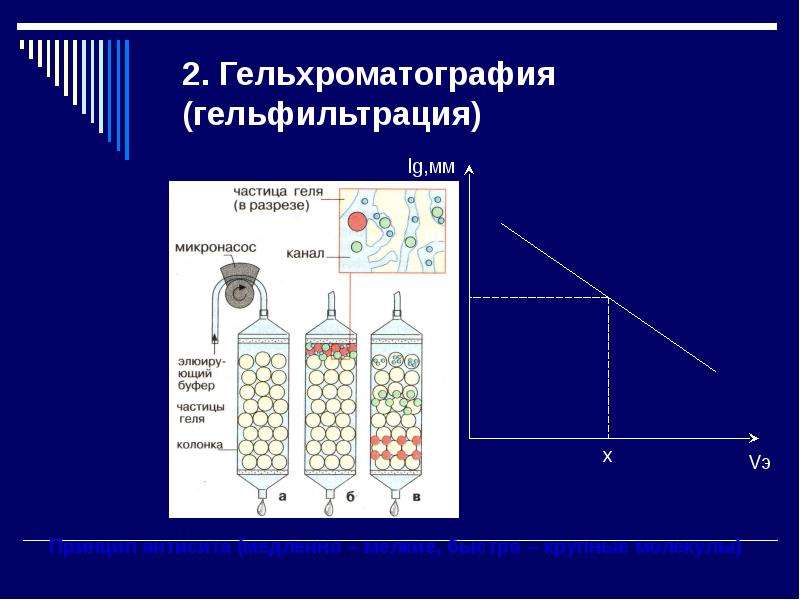
Различные виды хроматографии (ионообменная, аффинная, ЭФ, гельфильтрация)
Очистка (диализ, гельфильтрация, кристаллизация-высаливание, установка гомогенности)
№26 слайд


Содержание слайда: А – Н2О и крепкие солевые растворы >50%, 100% уменш.
А – Н2О и крепкие солевые растворы >50%, 100% уменш.
Г – н/р Н2О растворимы в солевых растворах до 50%, 50% уменш.
Проламины – 60о – 80о спирт
Глютелины – разбавленные щелочи
Протамины (80% арг лиз) и гистоны (30% арг лиз) – белки основного характера
В основе классификации гистонов арг/лиз, 5 классов: Н, Н2а, Н2в, Н3, Н4
Гистоны – небелковая часть нуклеопротеидов (структурная и регуляторная функции)
№27 слайд


Содержание слайда: Сложные белки
Хромопротеиды - окрашенные белки (chroma – краска)
Гемопротеиды – Нв, миоглобин, каталаза, пероксидаза, цитохромы
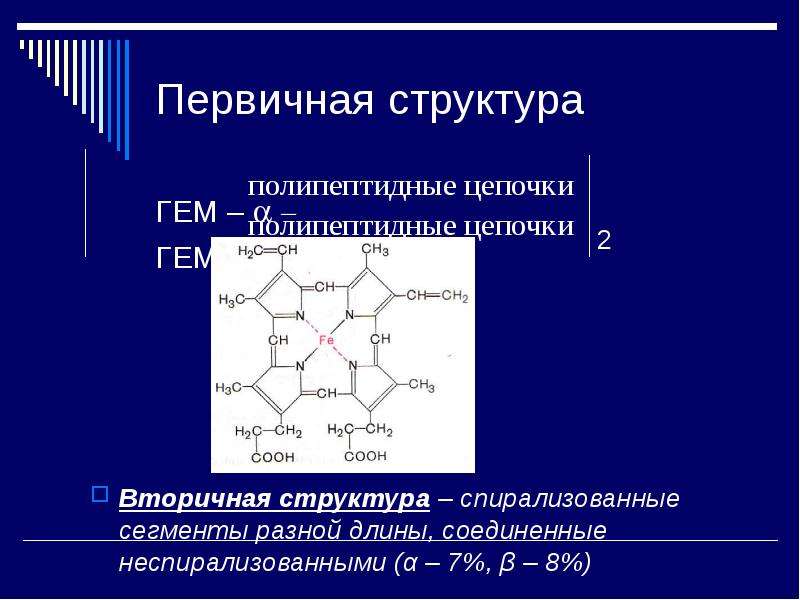
Простетическая часть – ГЕМ – металлопорфириновый комплекс
Нв = 96% глобин + 4% гем (глобин + 4 гема)
Глобин – белок с четверичной структурой, состоит из 4-х полипептидных цепочек
Нв А (взрослый) б2pб б – 141АК·2
574АК
в – 146АК·2
№29 слайд


Содержание слайда: Третичная структура – формирование субъединиц, внутри каждой образуется «гидрофобный» карман, в котором располагается Гем, который удерживается силами Ван дер Ваальса между неполярными участками Гема и гидрофобными радикалами АК. Кроме этого железо Гема 5-координационной связью с имидазольным радикалом гистидина в глобине.
№34 слайд


Содержание слайда: Фосфопротеиды
Небелковая часть – фосфорная кислота
Постоянный фосфопротеид – казеин молока
Временные фосфопротеиды – фосфатные модификации белка
Фосфорилированный белок дефосфорилированный белок
(сложный) (простой)
Металлопротеиды
Содержат ионы одного или нескольких металлов
Fe+2 ферритин, трансферрин, гемосидерин
Zn+2 карбоангидраза, карбоксипептидаза
Cu+2 цитохромоксидаза
Mg+2 фосфотрансферазы (киназы)
Mn+2 аргиназа
№35 слайд


Содержание слайда: Гликопротеиды
Простетические группы представлены углеводами и их производными
Глюкоза, манноза, галактоза, ксилоза, арабиноза, глюкуроновая, нейтралиновая, сиаловая кислоты
Глюкозоамингликаны: гиалуроновая, хондроитинсерная кислоты
В структуре соединительной ткани, много среди белков плазмы крови, в структуре рецепторов.
Выполняют: информативную функцию, защищают структуру белков от действия протеиназ, участвуют в иммунологических реакциях, ионном обмене, явлениях клеточной адгезии.
Скачать все slide презентации Физико-химические свойства белков одним архивом:
Похожие презентации
-
 Физико-химические свойства белков. Количественные (колориметрические) методы определения концентрации белка
Физико-химические свойства белков. Количественные (колориметрические) методы определения концентрации белка -
 Физико-химические свойства белков. Электрофоретические и хроматографические методы
Физико-химические свойства белков. Электрофоретические и хроматографические методы -
 По Химии "Физико-химические свойства алкинов" - скачать смотреть
По Химии "Физико-химические свойства алкинов" - скачать смотреть -
 Определение органолептических и физико-химических свойств мороженого Подг
Определение органолептических и физико-химических свойств мороженого Подг -
 Скачать презентацию Физико-химические свойства алкинов
Скачать презентацию Физико-химические свойства алкинов -
 Амины. Общая характеристика, номенклатура, изомерия. Получение. Физико-химические свойства. Отдельные представители
Амины. Общая характеристика, номенклатура, изомерия. Получение. Физико-химические свойства. Отдельные представители -
 Изучение физико-химических свойств яблок разных сортов и влияние их на здоровье школьников
Изучение физико-химических свойств яблок разных сортов и влияние их на здоровье школьников -
 Анализ физико-химических свойств синтетических моющих средств (СМС) и их значение в жизни человека
Анализ физико-химических свойств синтетических моющих средств (СМС) и их значение в жизни человека -
 Основные физико-химические свойства нефтей и нефтепродуктов
Основные физико-химические свойства нефтей и нефтепродуктов -
 Химические свойства белков
Химические свойства белков