Оцените презентацию от 1 до 5 баллов!
Тип файла:
ppt / pptx (powerpoint)
Всего слайдов:
45 слайдов
Для класса:
1,2,3,4,5,6,7,8,9,10,11
Размер файла:
8.19 MB
Просмотров:
83
Скачиваний:
0
Автор:
неизвестен
Слайды и текст к этой презентации:
№1 слайд
Содержание слайда: Химия элементов. Лекция
Общая характеристика элементов IIIA-группы. Бор. Алюминий
№2 слайд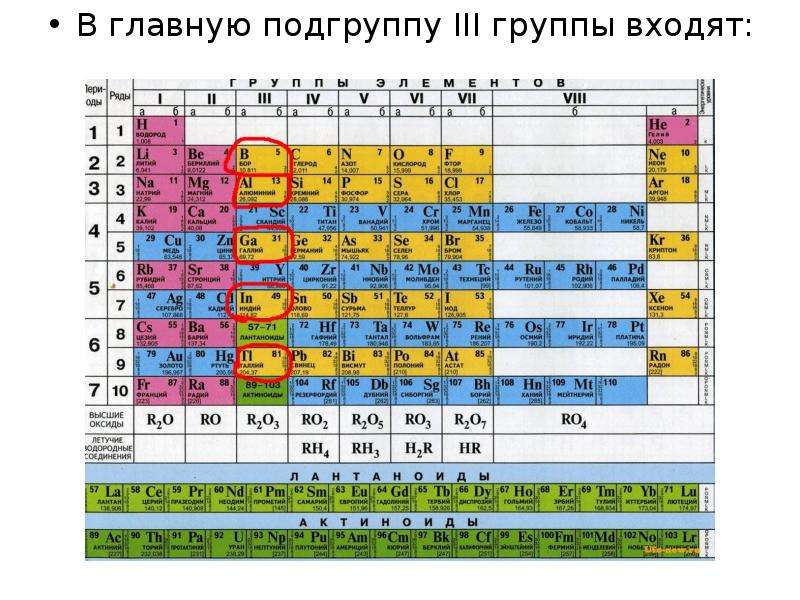
Содержание слайда: В главную подгруппу III группы входят:
В главную подгруппу III группы входят:
№3 слайд
Содержание слайда: III группа
Периодической системы
К р-элементам III группы относятся бор, алюминий, галлий, индий и таллий:
р- Элементы:
В 1s22s22p1
Al 2s22p63s23p1
Ga 3s23p63d104s24p1
In 4s24p64d105s25p1
Tl 4s24p64d104f145s25p65d106s26p1
№4 слайд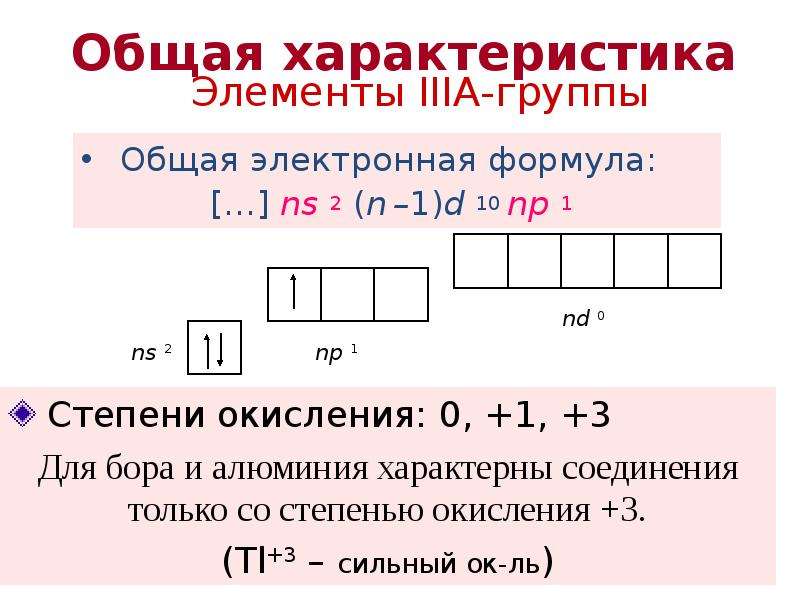
Содержание слайда: Элементы IIIА-группы
Общая электронная формула:
[…] ns 2 (n –1)d 10 np 1
№5 слайд
Содержание слайда: Элементы IIIA-группы
№6 слайд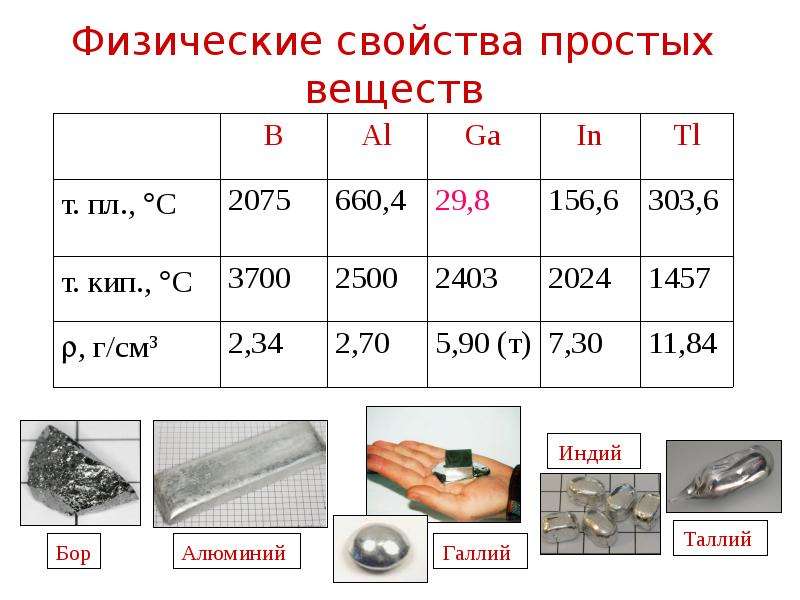
Содержание слайда: Физические свойства простых веществ
№7 слайд
Содержание слайда: Галлий.
Га́ллий мягкий пластичный металл серебристо-белого цвета с синеватым оттенком. Лёгкий металл.
№8 слайд
Содержание слайда: Индий.
И́ндий ковкий, легкоплавкий, очень мягкий металл серебристо-белого цвета.
№9 слайд
Содержание слайда: Таллий.
Та́ллий мягкий металл белого цвета с голубоватым оттенком. Относится к группе тяжёлых металлов. Сверхпроводник. На воздухе быстро тускнеет, покрываясь чёрной плёнкой оксида таллия Tl2O. Высокотоксичен.
№10 слайд
Содержание слайда: Кислородные соединения
Оксиды
№11 слайд
Содержание слайда: Гидроксиды
№12 слайд
№13 слайд
№14 слайд
Содержание слайда: Бор
Кристаллический бор построен из двадцатигранника, химически инертен.
№15 слайд
Содержание слайда: Особенности химии бора
№16 слайд
Содержание слайда: В обычных условиях кристаллический бор весьма инертен и непосредственно взаимодействует только со фтором.
В обычных условиях кристаллический бор весьма инертен и непосредственно взаимодействует только со фтором.
2B + 3F2 = 2BF3
при нагревании (400—700 °С) окисляется кислородом, серой, хлором (и др. галогенами).
4B (т) + 3O2 (г) = 2B2O3 (т),
2B + 3Cl2 = 2BCl3
С водородом бор не взаимодействует.
№17 слайд
Содержание слайда: Взаимодействие со сложными веществами
B + 3HNO3 = B(OH)3 + 3NO2
4B + 4NaOH(т) + 3 O2 = 4NaBO2 + 2H2O
(сплавление)
№18 слайд
Содержание слайда: Водородные соединения - бораны
№19 слайд
Содержание слайда: Бороводороды
Бороводороды
- химически весьма активны.
Так, большинство боранов на воздухе самовоспламеняются и сгорают с выделением очень большого количества тепла. Это позволяет использовать их в качестве ракетного топлива.
В2Н6 + 3О2 = В2О3 + 3Н2О + Q
Гидриды бора разлагаются водой, спиртами и щелочами с выделением водорода. Наиболее активно гидролизуется диборан:
В2Н6 + 6Н2О = 2Н3ВО3 + 6Н2
Большинство боранов имеет отвратительный запах и очень ядовиты!
№20 слайд
Содержание слайда: Оксид бора (III) В2O3
Оксид бора (III) В2O3 легко переходит в стеклообразное состояние и очень трудно кристаллизируется.
Как кислотный оксид В2O3 энергично взаимодействует с водой с образованием борной кислоты Н3ВO3.
В2O3 + 3Н2О = 2Н3ВO3
№21 слайд
№22 слайд
Содержание слайда: Ортоборная кислота
Ортоборат водорода (в растворе ортоборная кислота).
В твердом состоянии Н3ВО3 — чешуйки, жирные на ощупь.
Ортоборная кислота — очень слабая, одноосновная. В отличие от обычных кислот ее кислотные свойства обязаны не отщеплению протона, а присоединению ОН--ионов:
B(OH)3 + HOH = [B(OH)4]- + H+
№23 слайд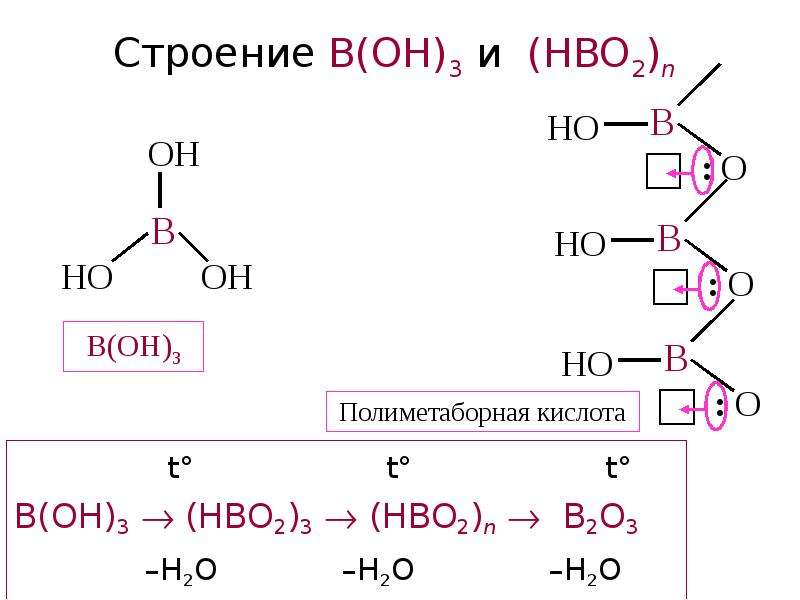
Содержание слайда: Строение B(OH)3 и (HBO2)n
t° t° t°
B(OH)3 (HBO2)3 (HBO2)n B2O3
–H2O –H2O –H2O
№24 слайд
Содержание слайда: При нейтрализации Н3ВO3 избытком щелочи образуются полибораты, выделяющиеся из растворов в виде кристаллогидратов, например:
При нейтрализации Н3ВO3 избытком щелочи образуются полибораты, выделяющиеся из растворов в виде кристаллогидратов, например:
4Н3ВО3 + 2NаОН + 3Н2O = Nа2В4О710Н2O
№25 слайд
Содержание слайда: Тетраборат натрия Na2B4O7·10H2O (бура)
Большинство оксоборатов в воде не растворяется. Кроме боратов s-элементов I группы.
Na2B4O7 + 2H2O = 2Na+ + [B4O72– · 2H2O]
№26 слайд
Содержание слайда: При прокаливании буры с солями некоторых металлов образуются двойные высокомолекулярные полиметабораты — стекла, часто окрашенные в характерные цвета, например: NаВО2Сr(ВО2)3 — зеленый, 2NаВО2Со(ВО2)2 — синий:
При прокаливании буры с солями некоторых металлов образуются двойные высокомолекулярные полиметабораты — стекла, часто окрашенные в характерные цвета, например: NаВО2Сr(ВО2)3 — зеленый, 2NаВО2Со(ВО2)2 — синий:
№27 слайд
Содержание слайда: Борная кислота против муравьев
эффективна за счет того, что влияет на работу его нервной системы. После всасывания в кишечнике она вызывает серьезные нарушения в работе нервной системы, которые через несколько часов переходят в паралич и смерть насекомого.
№28 слайд
Содержание слайда: Ортоборная кислота Н3ВО3
№29 слайд
№30 слайд
Содержание слайда: Нахождение в природе
№31 слайд
№32 слайд
№33 слайд
№34 слайд
Содержание слайда: ХИМИЧЕСКИЕ СВОЙСТВА
Al – активный металл, восстановитель. На воздухе всегда покрыт защитной оксидной плёнкой Al2O3. Поэтому при обычных условиях не вступает во взаимодействие с другими веществами.
№35 слайд
№36 слайд
№37 слайд
Содержание слайда: Взаимодействие со сложными веществами
Взаимодействие с водой (очищенный от оксидной пленки, например, амальгамированием или растворами горячей щёлочи): )
2 Al +6H2O=2Al(OH)3 +3H2
Взаимодействует с растворами кислот
2Al +6HCl= 2AlCl3 + 3H2
Взаимодействует с растворами щелочей
2Al+ 2NaOH + 6H2O=2Na[Al(OH)4]+3H2
тетрагидроксоалюминат
натрия
https://www.youtube.com/watch?v=YQF0R6UNE1A
https://www.youtube.com/watch?v=h-1dkeMGiKE
№38 слайд
Содержание слайда: УДАЛЕНИЕ ОКСИДНОЙ ПЛЕНКИ АЛЮМИНИЯ
https://www.youtube.com/watch?v=9wnYXTP1OC8
№39 слайд
Содержание слайда: Алюминий при обычных условиях не взаимодействует с концентрированными H2SO4 и
HNO3
№40 слайд
Содержание слайда: Домашнее задание
Подберите коэффициенты методом электронного баланса:
Al + разб. H2SO4= Al2(SO4)3 + SO2 + H2O
Al + разб. HNO3 = Al(NO3)3 + NO2 + H2O
№41 слайд
Содержание слайда: Гидроксид алюминия Аl(ОН)3 — полимерное соединение. Так, природный гидроксид (минерал гидраргиллит) имеет слоистую кристаллическую решетку.
Гидроксид алюминия Аl(ОН)3 — полимерное соединение. Так, природный гидроксид (минерал гидраргиллит) имеет слоистую кристаллическую решетку.
. Получаемый по обменной реакции гидроксид – студенистый белый осадок.
Аl3+ + 3ОН- = Аl(ОН)3
Состав и структура осадка А12О3nН2О существенно зависят от условий получения и хранения.
№42 слайд
Содержание слайда: При прокаливании гидроксида алюминия А12О3nН2О постепенно теряет воду, превращаясь в конечном счете в А12О3. Одна из форм дегидратированного гидроксида — алюмогель используется в технике в качестве адсорбента.
При прокаливании гидроксида алюминия А12О3nН2О постепенно теряет воду, превращаясь в конечном счете в А12О3. Одна из форм дегидратированного гидроксида — алюмогель используется в технике в качестве адсорбента.
№43 слайд
№44 слайд
№45 слайд
Содержание слайда: Использование соединений алюминия в медицине






















































